Hashimotov tiroiditis
| Hashimotov tiroiditis | |
|---|---|
| Sopomenka | kronični limfocitni tiroiditis, avtoimunski tiroiditis, struma lymphomatosa, Hashimotova bolezen |
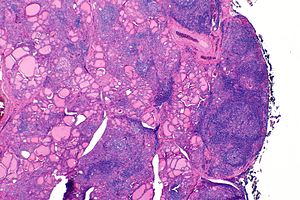 | |
| Ščitnica bolnika s Hashimotovim tiroiditisom pod mikroskopom pri majhni povečavi | |
| Specialnost | endokrinologija |
| Simptomi | neboleča golša, povečanje telesne mase, utrujenost, zaprtje, depresija, suha koža, alopecija[1] |
| Običajni začetek | starost 30–50 let[1][2] |
| Vzroki | genetski in okoljski dejavniki.[3] |
| Dejavniki tveganja | družinska anamneza, druga avtoimunska bolezen[1] |
| Diagnostični postopki | TSH, T4, antitiroidna avtoprotitelesa[1] |
| Diferencialne diagnoze | Basedowova bolezen, netoksična nodularna golša[4] |
| Zdravljenje | levotiroksin, operacija[1][4] |
| Pogostost | 5 % v nekem trenutku[3] |
Hashimotov tiroiditis, znan tudi kot kronični limfocitni tiroiditis in Hashimotova bolezen, je avtoimunska bolezen, pri kateri pride do postopnega uničenja ščitnice.[5] Na začetku bolnik simptomov morda ne opazi. Sčasoma se ščitnica lahko poveča in tvori nebolečo golšo. Pri nekaterih ljudeh se sčasoma pojavi hipotiroidizem, ki se lahko kaže s povečanjem telesne mase, utrujenostjo, zaprtjem, depresijo, izpadanjem las in dlak ter splošnimi bolečinami. Po dolgih letih se ščitnica običajno zmanjša.[1] Mogoči zapleti vključujejo ščitnični limfom.[6]
Domneva se, da je Hashimotov tiroiditis posledica kombinacije genetskih in okoljskih dejavnikov.[3] Dejavniki tveganja vključujejo družinsko anamnezo tega stanja in druge avtoimunske bolezni.[1] Diagnozo potrdimo s krvnimi preiskavami na TSH, T4 in antitiroidna avtoprotitelesa. Druga stanja, ki lahko povzročijo podobne simptome, vključujejo Basedowovo bolezen in netoksično nodularno golšo.[4]
Hashimotov tiroiditis se običajno zdravi z levotiroksinom.[1][7] Če hipotiroidizem ni izražen, nekateri ne priporočajo nobenega zdravljenja, drugi pa poskušajo zmanjšati velikost golše.[8] Bolniki naj se izogibajo uživanju velikih količin joda; vendar je treba uživati dovolj joda, še zlasti med nosečnostjo. Redko je potrebno operacijsko zdravljenje golše.[4]
Hashimotov tiroiditis v določenem obdobju življenja prizadene približno 5 % belcev.[3] Običajno se začne med 30. in 50. letom in je veliko pogostejši pri ženskah kot pri moških.[1] [2] Zdi se, da se pogostnost te bolezni povečuje.[4] Prvi jo je leta 1912 opisal japonski zdravnik Hakaru Hashimoto.[9] Leta 1957 je bila prepoznana kot avtoimunska bolezen.[10]
Znaki in simptomi[uredi | uredi kodo]
S Hashimotovim tiroitiditisom povezujejo številne simptome. Najpogostejši simptomi so utrujenost, povečanje telesne mase, bled ali otekel obraz, mrazenje, bolečine v sklepih in mišicah, zaprtje, suhi in redkejši lasje, močan menstruacijski tok ali neredne menstruacije, depresija, panična motnja, upočasnjen srčni utrip ter težave z zanositvijo in ohranjanjem nosečnosti.[11]
Hashimotova bolezen je približno sedemkrat pogostejša pri ženskah kot pri moških. Pojavi se lahko pri najstnikih in mladih ženskah, pogosteje pa se pojavi v srednjih letih, zlasti pri moških. Ljudje, pri katerih se pojavi Hashimotova bolezen, imajo pogosto družinske člane, ki imajo ščitnične ali druge avtoimunske bolezni, včasih pa imajo tudi sami druge avtoimunske bolezni.[12]
Ščitnična žleza lahko pri Hashimotovem tiroiditisu postane čvrsta, velika in lobulirana, vendar so spremembe v ščitnici lahko tudi neopazne.[13] Povečanje ščitnice je posledica limfocitne infiltracije in fibroze, ne pa hipertrofije tkiva. Čeprav je njihova vloga pri začetnem uničenju foliklov nejasna, so protitelesa proti ščitnični peroksidazi ali tiroglobulinu pomembna, saj se uporabljajo kot označevalci za odkrivanje bolezni in ugotavljanje njene resnosti.[14] Menijo, da so sekundarni produkti uničenja žleze, posredovanega s celicami T.[15]
Za Hashimotov tiroiditis je značilna tudi infitracija ščitničnega tkiva z levkociti, predvsem limfociti T. Redka, toda resna zapleta sta ščitnični limfom, običajno B-celični, in ne-Hodgkinov limfom.[16]
Dejavniki tveganja[uredi | uredi kodo]
Močno genetsko komponento so potrdili v študijah z monozigotnimi dvojčki, ki so ne glede na klinično sliko pokazale 38–55-odstotno skladnost in še večjo skladnost protiteles proti ščitnici v obtoku (pri monozigotnih dvojčkih do 80 %). Pri dizigotnih dvojčkih niso opazili podobne stopnje skladnosti, kar močno podpira izrazito genetsko etiologijo.[17]
Geni HLA[uredi | uredi kodo]
Prvi genski lokus, ki so ga povezali z avtoimunsko boleznijo ščitnice, je bil glavni kompleks histokompatibilnosti (MHC) na kromosomu 6p21, ki kodira HLA-je. Specifični aleli za HLA-je imajo večjo afiniteto za avtoantigene ščitnične peptide in lahko prispevajo k nastanku avtoimunskih bolezni ščitnice. Pri Hashimotovi bolezni so specifično dokazali nepravilno izražanje HLA II na tirocitih. Ti Lahko predstavljajo avtoantigene ščitnice in sprožijo avtoimunsko bolezen.[18] Aleli dovzetnosti za Hashimotovo bolezen so lahko različni. Pri belcih naj bi bili to med drugim aleli DR3, DR5 in DQ7.[19] [20]
Gen CTLA-4[uredi | uredi kodo]
Ta gen je drugi pomemben imunoregulacijski gen, povezan z avtoimunsko boleznijo ščitnice. Polimorfizmi gena CTLA-4 lahko prispevajo k zmanjšanemu zaviranju proliferacije celic T in povečajo dovzetnost za avtoimunski odziv.[21] CTLA-4 je pomemben gen za nagnjenost k tvorbi protiteles proti ščitnici. Analiza povezanosti celotnega genoma je pokazala povezanost regije CTLA-4 s prisotnostjo avtoprotiteles proti ščitnici.[22] Gen CTLA-4 so potrdili kot glavni lokus za ščitnična avtoprotitelesa.[23]
Nereceptorski gen tipa 22 proti tirozin fosfatazi[uredi | uredi kodo]
PTPN22 je zadnji identificirani imunoregulacijski gen, ki so ga povezali z avtoimunsko boleznijo ščitnice. Leži na kromosomu 1p13 in se izraža v limfocitih. Deluje kot negativni regulator aktivacije celic T. Mutacija tega gena je dejavnik tveganja za številne avtoimunske bolezni. Šibkejše signaliziranje celic T lahko privede do motenega odstranjevanja timusnih celic celic T, povečana funkcija PTPN22 pa lahko zavira regulativne celice T, ki ščitijo pred avtoimunostjo.[24]
Imunski geni[uredi | uredi kodo]
IFN-γ spodbuja celično posredovano citotoksičnost proti ščitnici. Mutacije, ki povzročijo povečano tvorbo IFN-γ, so povezali z resnostjo hipotiroidizma.[25] Hud hipotiroidizem povezujejo z mutacijami, ki vodijo k manjši tvorbi IL-4 (citokini Th2, ki zavirajo celično posredovano avtoimunost),[26] manjšim izločanjem TGF-β (zaviralec proizvodnje citokinov)[27] in mutacijami gena FoxP3, ki je ključni regulacijski dejavnik za pojav celic Treg.[28] Razvoj Hashimotove bolezni so povezali z mutacijo gena za TNF-α (spodbujevalec proizvodnje IFN-γ), kar je povzročilo njegovo večjo koncentracijo.[29]
Z razvojem avtoimunske bolezni ščitnice pri genetsko predisponiranih osebah povezujejo dejavnike, ki jih je mogoče preprečevati, vključno z velikim vnosom joda, pomanjkanjem selena in nalezljivimi boleznimi ter nekaterimi zdravili.[30]
Jod[uredi | uredi kodo]
Čezmeren vnos joda je široko sprejet okoljski dejavnik za sprožitev ščitnične avtoimunosti. Pogostnost avtoprotiteles ščitnice je večja na območjih z več razpoložljivega joda. Predlagali so več mehanizmov, po katerih naj bi jod spodbujal ščitnično avtoimunost. Izpostavljenost jodu povečuje jodiranost tiroglobulina in z ustvarjanjem novih epitopov, ki vsebujejo jod, ali izpostavljanjem kriptičnih epitopov povečuje njegovo imunogenost. Morda lahko olajša predstavitev s pomočjo antigen-predstavitvenih celic, poveča vezavno afiniteto T-celičnega receptorja in aktivira specifične celice T.[31]
Izkazalo se je, da izpostavljenost jodu povečuje raven reaktivnih kisikovih vrst. Te okrepijo izražanje znotrajcelične adhezijske molekule-1 na folikularnih celicah ščitnice, ki bi lahko v ščitnico privabile imunokompetentne celice.[32]
Jod je strupen za tirocite, saj se lahko visokoreaktivne kisikove vrste vežejo na lipide in beljakovine v celični membrani. Povzroča poškodbe tirocitov in sproščanje avtoantigenov. Jod spodbuja tudi apoptozo folikularnih celic in vpliva na imunske celice (povečano zorenje dendritičnih celic, povečano število celic T, spodbujanje proizvodnje B-celičnega imunoglobulina).[33] [34]
Podatki iz danske raziskave povezanosti vnosa joda in bolezni ščitnice so pokazali, da so v dveh kohortah (moški, ženske) z zmernim in blagim pomanjkanjem joda ravni tako protiteles proti ščitnični peroksidazi kot tudi protiteles proti tiroglobulinu višje pri ženskah, stopnja pogostnosti obojih protiteles pa narašča s starostjo.[35]
Spol[uredi | uredi kodo]
V študiji z zdravimi danskimi dvojčki, razdeljenimi v tri skupine (monozigotni in dizigotični istospolni dvojčki in dvojčki nasprotnega spola), so ocenili, da je bil genetski prispevek k dovzetnosti za nastanek protiteles proti ščitnični peroksidazi 61-odstoten pri moških in 72-odstoten pri ženskah, prispevek k dovzetnosti za nastanek protiteles proti tiroglobulinu pa 39-odstoten pri moških in 75-odstoten pri ženskah.[36]
Močno prevladovanje žensk pri ščitnični avtoimunosti bi bilo lahko povezano s kromosomom X. Ta vsebuje spolne in imunske gene, ki so odgovorni za imunsko toleranco.[37] Poročali so o večji pojavnosti ščitnične avtoimunosti pri bolnicah z višjo stopnjo monosomije kromosoma X v perifernih belih krvnih celicah.[38]
Drugi mogoči mehanizem bi bila lahko neenakomerna inaktivacija kromosomov X, ki bi privedla do pobega X-vezanih lastnih antigenov iz predstavitve v timusu in do izgube tolerance celic T.
Dejavnik tveganja za Hashimotovo bolezen so druge avtoimunske bolezni, velja pa tudi obratno.[1] Avtoimunske bolezni, ki jih najpogosteje povezujejo s Hashimotovim tiroiditisom, vključujejo celiakijo, diabetes tipa 1, vitiligo in alopecijo.[39]
Vpleteni geni se lahko razlikujejo med različnimi etničnimi skupinami, pojavnost pa je večja pri ljudeh s kromosomskimi motnjami, vključno s Turnerjevim, Downovim in Klinefelterjevim sindromom, ki so običajno povezane z avtoprotitelesi proti tiroglobulinu in ščitnični peroksidazi. Postopno izčrpavanje teh celic zaradi citotoksičnega imunskega odziva vodi do višjih stopenj primarnega hipotiroidizma, ki se kaže z nizkimi ravnmi T3/T4 in kompenzacijskim zvišanjem ravni TSH.
Patofiziologija[uredi | uredi kodo]
Za nastanek patologije Hashimotovega tiroiditisa so predlagali številne mehanizme.
Prisotna so lahko različna protitelesa proti ščitnični peroksidazi, tiroglobulinu in receptorjem TSH, čeprav majhen odstotek ljudi morda nima nobenega od teh protiteles. Kot navajajo v različnih študijah dvojčkov, ima lahko določen odstotek prebivalstva ta protitelesa, ne da bi se pri tem izrazil Hashimotov tiroiditis. Kljub temu je pomemben dejavnik za apoptotično propadanje celic pri Hashimotovem tiroiditisu od protiteles odvisna, celično posredovana citotoksičnost. Osrednjega pomena za uničenje tirocitov je aktivacija citotoksičnih limfocitov T (celic CD8+) kot odziv na celični imunski odziv, posredovan s celicami T pomagalkami (celice T CD4+). Kot je značilno za preobčutljivost tipa IV, je še en učinek aktivacije limfocitov T pomagalk rekrutiranje makrofagov, saj limfociti osi Th1, ki v ščitničnem tkivu proizvajajo vnetne citokine, omogočajo nadaljnjo aktivacijo makrofagov in njihovo migracijo v ščitnico za neposredno učinkovanje.
Makroskopske morfološke spremembe v ščitnici se kažejo kot njeno splošno povečanje, ki je veliko bolj lokalno nodularno in nepravilno kot pri bolj difuznih vzorcih (npr. hipertiroidizmu). Ko je kapsula žleze neprizadeta in se sama žleza še vedno razlikuje od okoliškega tkiva, lahko mikroskopski pregled bolje razkrije stopnjo poškodbe.[40]
Histološko se preobčutljivost kaže kot difuzna parenhimska infiltracija z limfociti, zlasti plazemskimi celicami B, ki jih pogosto lahko vidimo kot sekundarne limfatične folikle (germinalne centre, ki jih ne smemo zamenjati z normalno prisotnimi koloidno napolnjenimi folikli, ki gradijo ščitnico). Atrofijo koloidnih teles obdajajo Hürthlejeve celice z močno eozinofilno, zrnato citoplazmo, tj. metaplazija običajnih kubičnih celic, ki tvorijo sluznico ščitničnih foliklov. Močna atrofija ščitnice se pogosto kaže z gostejšimi fibroznimi kolagenskimi trakovi, ki ostanejo znotraj meja ščitnične kapsule.[40]
Diagnoza[uredi | uredi kodo]

Diagnozo običajno postavijo tako, da v serumu določijo zvišano raven protiteles proti tiroidni peroksidazi, možen pa je tudi seronegativni (brez avtoprotiteles v obtoku) tiroiditis.[41]
Glede na razmeroma nespecifične simptome začetnega hipotiroidizma Hashimotov tiroiditis pogosto napačno diagnosticirajo kot depresijo, ciklotimijo, predmenstruacijski sindrom, sindrom kronične utrujenosti, fibromialgijo in redkeje kot erektilno disfunkcijo ali anksiozno motnjo. Pri grobem pregledu se pogosto pojavi trda golša, ki ni boleča na dotik;[40] drugi simptomi, ki jih opazimo pri hipotiroidizmu, kot je periorbitalni miksedem, so odvisni od trenutnega stanja napredovanja odziva, zlasti glede na običajno postopen razvoj klinično pomembnega hipotiroidizma. Pri postavitvi točne diagnoze je lahko v pomoč testiranje na tirotropin (ščitnico spodbujajoči hormon) (TSH), prosti T3 in prosti T4 ter protitelesa proti tiroglobulinu (anti-Tg), protitelesa proti ščitnični peroksidazi (anti-TPO ali TPOAb) in antimikrosomska protitelesa.[42] Pri začetni oceni osebe lahko zaradi prehodne tirotoksikoze ugotovijo zvišane ravni tiroglobulina, saj vnetje ščitnice poškoduje zalogo tiroglobulina v ščitničnih foliklih; kot odgovor na zmanjšanje zaviranja negativnih povratnih informacij zaradi zmanjšanja serumskih ščitničnih hormonov se poveča izločanje TSH iz adenohipofize. Običajno je najprimernejši ščitnični hormonski test za hipotiroidizem določitev ravni T4.[43] Izpostavljenost telesa precejšnjim količinam predhodno izoliranih ščitničnih encimov naj bi prispevala k poslabšanju tolerance in povzročila izrazitejše simptome, ki jih pri bolezni opažajo pozneje. Limfocitna infiltracija tkiv, povezanih s tirociti, pogosto privede do histološko pomembne ugotovitve nastanka germinalnega centra v ščitnici.
Hashimototov tiroiditis, ki se kaže kot manija, se po psihiatru Ashoku Prasadu, ki ga je prvi opisal, imenuje Prasadov sindrom.[44]
Zdravljenje[uredi | uredi kodo]
[uredi | uredi kodo]
Hipotiroidizem, ki ga povzroča Hashimotov tiroiditis, se zdravi z učinkovinami za nadomeščanje ščitničnih hormonov, kot so levotiroksin, trijodotironin ali posušeni izvleček ščitnice. Tableta, ki se jemlje enkrat na dan, običajno omogoča ohranjanje normalne ravni ščitničnih hormonov. Zdravljenje je večinoma dosmrtno. Če je vzrok hipotiroidizma Hashimotov tiroiditis, je priporočljivo, da se ravni TSH ohranjajo pod 3,0 mIE/l.[45]
Prognoza[uredi | uredi kodo]
Najpogostejši zaplet je izražena, simptomatična disfunkcija, pri čemer do odpovedi ščitnice vsako leto napreduje približno 5 % ljudi s subkliničnim hipotiroidizmom in kroničnim avtoimunskim tiroiditisom. Včasih se pojavijo prehodna obdobja tirotoksikoze (čezmerne aktivnosti ščitnice) in redko lahko bolezen napreduje v popolno hipertiroidno Basedowovo bolezen z aktivno orbitopatijo (izbočene, vnete oči). Redki primeri fibroznega avtoimunskega tiroiditisa se kažejo s hudo zasoplostjo in težavami s požiranjem, ki spominjajo na agresivne tumorje ščitnice, vendar se takšni simptomi vedno izboljšajo s kirurškim posegom ali zdravljenjem s kortikosteroidi. Primarni ščitnični limfom celic B prizadene manj kot enega od 1000 bolnikov, verjetneje pa bolnike z dolgoletnim avtoimunskim tiroiditisom.[46]
Epidemiologija[uredi | uredi kodo]
Ta motnja naj bi bila najpogostejši vzrok primarnega hipotiroidizma v Severni Ameriki; je med najpogostejšimi vzroki za neendemsko golšo.[40] Hashimotov tiroiditis v določenem obdobju življenja prizadene približno 5 % belcev.[3] V ZDA prizadene manj Afroameričanov, vendar je povezan z večjo smrtnostjo afroameriškega prebivalstva.[47] Manj pogost je tudi pri azijskem prebivalstvu.[48] To bolezen ima v katerem koli trenutku približno 1,0 do 1,5 na 1000 ljudi. Pri ženskah se pojavlja od 8- do 15-krat pogosteje kot pri moških. Čeprav se lahko pojavi v kateri koli starosti, tudi pri otrocih, ga najpogosteje opažajo pri ženskah, starih od 30 do 60 let.[46] Nekatere raziskave razlagajo razliko med spoloma z vlogo posteljice.[49]
Pogostejši je na območjih z visokim vnosom joda in pri genetsko dovzetnih ljudeh.[46]
Zgodovina[uredi | uredi kodo]
Hashimotov tiroiditis, znan tudi kot Hashimotova bolezen, se imenuje po japonskem zdravniku Hakaruju Hashimotu (1881−1934) z medicinske fakultete Univerze Kyushu,[50] ki je prvi opisal simptome oseb s stanjem struma lymphomatosa, intenzivno limfocitno infiltracijo ščitnice, leta 1912 v nemški publikaciji.[51]
Leta 1957 so ga prepoznali kot avtoimunsko motnjo in je bil prva ugotovljena avtoimunska motnja, specifična za organ.[10]
Nosečnost[uredi | uredi kodo]
Pri nosečnicah, ki so pozitivne na Hashimotov tiroiditis, je lahko delovanje ščitnice zmanjšano ali pa žleza popolnoma odpove.[52] Če je ženska pozitivna na TPOAb, jo lahko zdravniki obvestijo o tveganjih zase in njene otroke, če se ne zdravijo. Protitelesa proti ščitnični peroksidazi (TPOAb) odkrijejo pri 10 % nosečnic in za te nosečnice pomenijo tveganje. Pri ženskah s šibko ščitnično funkcijo, ki ni stabilizirana, je večje tveganje za dojenčka z nizko porodno težo, neonatalno dihalno stisko, hidrocefalusom, hipospadijo, splav in prezgodnji porod.[53] Zdravljenje Hashimotove bolezni je povezano z večjo uspešnostjo embrionalne transplantacije in večjim deležem uspešnega izida nosečnosti. Priporočljivo je, da se zdravi samo nosečnice, ki so pozitivne za TPO v celotni nosečnosti, in da se pri vseh nosečnicah pregleda raven ščitničnih hormonov. Tesno sodelovanje med endokrinologom in porodničarjem je koristno za žensko in otroka.[54] [55] Ameriško združenje Endocrine Society priporoča pri nosečnicah z velikim tveganjem za avtoimunsko bolezen ščitnice presejanje.[56]
Testiranje protiteles proti ščitnični peroksidazi se priporoča pri vseh ženskah, ki so bile kadar koli noseče, ne glede na izid nosečnosti. ». . . [P]redhodna nosečnost ima pri predmenopavznih ženskah pomembno vlogo pri nastanku izraženega avtoimunskega hipotiroidizma, pri ocenjevanju tveganja za hipotiroidizem pri mladih ženskah pa je treba upoštevati število prejšnjih nosečnosti.«[57]
Hormonske spremembe in izražanje ključnih imunomodulatornih molekul trofoblasta povzročijo imunosupresijo in fetalno toleranco. Glavni dejavniki pri regulaciji imunskega odziva so celice Treg. Tako celični kot humoralni imunski odziv sta oslabljena, posledici česar sta imunska toleranca in supresija avtoimunosti. Poročali so, da se med nosečnostjo zmanjša raven protiteles proti ščitnični peroksidazi in tiroglobulinu. Po porodu se število celic Treg hitro zmanjša in imunski odziv se znova okrepi. To lahko povzroči pojav ali poslabšanje avtoimunske bolezni ščitnice.[58] Pri približno 50 % žensk s protitelesi proti ščitnični peroksidazi v zgodnji nosečnosti se poslabšanje avtoimunosti proti ščitnici v poporodnem obdobju kaže kot poporodni tiroiditis.[59] Pri ženskah s poporodnim tiroiditisom so poročali o večjem izločanju IFN-γ in IL-4 ter manjši koncentraciji kortizola v plazmi kot pri zdravih ženskah. Zdi se, da bi lahko šibkejša imunosupresija med nosečnostjo prispevala k poporodni disfunkciji ščitnice.[60]
Fetalni mikrohimerizem[uredi | uredi kodo]
Nekaj let po porodu lahko v materini periferni krvi, ščitnici, pljučih, koži ali bezgavkah zaznamo himerne moške celice. Imunske celice ploda v materini ščitnici se lahko aktivirajo in delujejo kot sprožilec, ki lahko sproži ali poslabša avtoimunsko bolezen ščitnice. Pri bolnicah s Hashimotovo boleznijo so v ščitnici odkrili plodove mikrohimerne celice v bistveno večjem številu kot pri zdravih ženskah.[61]
Glej tudi[uredi | uredi kodo]
- Hashimotova encefalopatija
- Miksedematozna psihoza
Reference[uredi | uredi kodo]
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 »Hashimoto's Disease«. NIDDK. Maj 2014. Arhivirano iz prvotnega spletišča dne 22. avgusta 2016. Pridobljeno 9. avgusta 2016.
- ↑ 2,0 2,1 Hiromatsu, Yuji; Satoh, Hiroshi; Amino, Nobuyuki (Januar 2013). »Hashimoto's Thyroiditis: History and Future Outlook«. Hormones. 12 (1): 12–18. doi:10.1007/BF03401282. PMID 23624127.
- ↑ 3,0 3,1 3,2 3,3 3,4 Pyzik, A; Grywalska, E; Matyjaszek-Matuszek, B; Roliński, J (2015). »Immune disorders in Hashimoto's thyroiditis: what do we know so far?«. Journal of Immunology Research. 2015: 979167. doi:10.1155/2015/979167. PMC 4426893. PMID 26000316.
- ↑ 4,0 4,1 4,2 4,3 4,4 Akamizu, T; Amino, N; Feingold, KR; Anawalt, B (2000). »Hashimoto's Thyroiditis«. V Akamizu, Takashi (ur.). Endotext. MDText. PMID 25905412.
- ↑ »Hashimoto's disease«. Office on Women’s Health, U.S. Department of Health and Human Services. 12. junij 2017. Arhivirano iz prvotnega spletišča dne 28. julija 2017. Pridobljeno 17. julija 2017.
 Članek vsebuje besedilo iz tega vira, ki je v javni domeni.
Članek vsebuje besedilo iz tega vira, ki je v javni domeni.
- ↑ Noureldine, SI; Tufano, RP (Januar 2015). »Association of Hashimoto's thyroiditis and thyroid cancer«. Current Opinion in Oncology. 27 (1): 21–5. doi:10.1097/cco.0000000000000150. PMID 25390557.
- ↑ »Hashimoto Thyroiditis – Endocrine and Metabolic Disorders«. Merck Manuals Professional Edition (v angleščini). Julij 2016. Pridobljeno 30. decembra 2017.
- ↑ »Hashimoto Thyroiditis – Hormonal and Metabolic Disorders«. Merck Manuals Consumer Version (v angleščini). Pridobljeno 30. decembra 2017.
- ↑ Shoenfeld, Yehuda; Cervera, Ricard; Gershwin, M. Eric (2010). Diagnostic Criteria in Autoimmune Diseases. Springer Science & Business Media. str. 216. ISBN 978-1-60327-285-8.
- ↑ 10,0 10,1 Moore, Elaine A.; Wilkinson, Samantha (2009). The Promise of Low Dose Naltrexone Therapy: Potential Benefits in Cancer, Autoimmune, Neurological and Infectious Disorders. McFarland. str. 30. ISBN 978-0-7864-5258-3.
- ↑ »Hashimoto's disease – Symptoms and causes«. Mayo Clinic (v angleščini). Pridobljeno 5. oktobra 2018.
- ↑ »Hashimoto's disease fact sheet«. Office on Women's Health, U.S. Department of Health and Human Services, womenshealth.gov (or girlshealth.gov). 16. julij 2012. Arhivirano iz prvotnega spletišča dne 2. decembra 2014. Pridobljeno 23. novembra 2014.
- ↑ Page 56 in: Staecker, Hinrich; Thomas R. Van De Water; Van de Water, Thomas R. (2006). Otolaryngology: basic science and clinical review. Stuttgart: Thieme. ISBN 978-0-86577-901-3.
- ↑ »Pathogenesis of Hashimoto's thyroiditis (chronic autoimmune thyroiditis)«. UpToDate.
- ↑ »Hashimoto Thyroiditis«. NCBI StatPearls. 2019.
- ↑ Dayan, Colin M.; Daniels, Gilbert H. (11. julij 1996). »Chronic Autoimmune Thyroiditis«. New England Journal of Medicine. 335 (2): 99–107. doi:10.1056/NEJM199607113350206. PMID 8649497.
- ↑ Chistiakov, Dimitry A (2005). »Immunogenetics of Hashimoto's thyroiditis«. Journal of Autoimmune Diseases. 2 (1): 1. doi:10.1186/1740-2557-2-1. PMC 555850. PMID 15762980.
- ↑ Jacobson, Eric M.; Huber, Amanda; Tomer, Yaron (2008). »The HLA gene complex in thyroid autoimmunity: From epidemiology to etiology«. Journal of Autoimmunity. 30 (1–2): 58–62. doi:10.1016/j.jaut.2007.11.010. PMC 2244911. PMID 18178059.
- ↑ Tendon, N.; Zhang, L.; Weetman, A. P. (Maj 1991). »HLA Associations with Hashimoto's thyroiditis«. Clinical Endocrinology. 34 (5): 383–386. doi:10.1111/j.1365-2265.1991.tb00309.x. PMID 1676351.
- ↑ Bogner, U.; Badenhoop, K.; Peters, H.; Schmieg, D.; Mayr, W. R.; Usadel, K. H.; Schleusener, H. (Januar 1992). »Hla-Dr/Dq Gene Variation in Nongoitrous Autoimmune Thyroiditis at the Serological and Molecular Level«. Autoimmunity. 14 (2): 155–158. doi:10.3109/08916939209083135. PMID 1363895.
- ↑ Zaletel, Katja; Gaberšček, Simona (december 2011). »Hashimoto's Thyroiditis: From Genes to the Disease«. Current Genomics. 12 (8): 576–588. doi:10.2174/138920211798120763. PMC 3271310. PMID 22654557.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Tomer, Yaron; Greenberg, David A.; Barbesino, Giuseppe; Concepcion, Erlinda; Davies, Terry F. (Marec 2001). »CTLA-4 and Not CD28 Is a Susceptibility Gene for Thyroid Autoantibody Production 1«. The Journal of Clinical Endocrinology & Metabolism. 86 (4): 1687–1693. doi:10.1210/jcem.86.4.7372. PMID 11297604.
- ↑ Ban, Y; Davies, T F; Greenberg, D A; Kissin, A; Marder, B; Murphy, B; Concepcion, E S; Villanueva, R B; Barbesino, G; Ling, V; Tomer, Y (december 2003). »Analysis of the CTLA-4, CD28, and inducible costimulator (ICOS) genes in autoimmune thyroid disease«. Genes & Immunity. 4 (8): 586–593. doi:10.1038/sj.gene.6364018. PMID 14647199.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Burn, Garth L.; Svensson, Lena; Sanchez-Blanco, Cristina; Saini, Manoj; Cope, Andrew P. (1. december 2011). »Why is PTPN22 a good candidate susceptibility gene for autoimmune disease?«. FEBS Letters. 585 (23): 3689–3698. doi:10.1016/j.febslet.2011.04.032. PMID 21515266.
- ↑ Ito, Chisato; Watanabe, Mikio; Okuda, Noriko; Watanabe, Chikami; Iwatani, Yoshinori (2006). »Association between the Severity of Hashimoto's Disease and the Functional +874A/T Polymorphism in the Interferon-.GAMMA. Gene«. Endocrine Journal. 53 (4): 473–478. doi:10.1507/endocrj.k06-015. PMID 16820703.
- ↑ Nanba, Takashi; Watanabe, Mikio; Akamizu, Takashi; Iwatani, Yoshinori (1. marec 2008). »The −590CC Genotype in the IL4 Gene as a Strong Predictive Factor for the Development of Hypothyroidism in Hashimoto Disease«. Clinical Chemistry. 54 (3): 621–623. doi:10.1373/clinchem.2007.099739. PMID 18310157.
- ↑ Yamada, H.; Watanabe, M.; Nanba, T.; Akamizu, T.; Iwatani, Y. (Marec 2008). »The +869T/C polymorphism in the transforming growth factor-β1 gene is associated with the severity and intractability of autoimmune thyroid disease: TGF-β1 SNP and autoimmune thyroid disease«. Clinical & Experimental Immunology. 151 (3): 379–382. doi:10.1111/j.1365-2249.2007.03575.x. PMC 2276968. PMID 18190611.
- ↑ Inoue, N.; Watanabe, M.; Morita, M.; Tomizawa, R.; Akamizu, T.; Tatsumi, K.; Hidaka, Y.; Iwatani, Y. (december 2010). »Association of functional polymorphisms related to the transcriptional level of FOXP3 with prognosis of autoimmune thyroid diseases: FoxP3 SNP and autoimmune thyroid disease«. Clinical & Experimental Immunology. 162 (3): 402–406. doi:10.1111/j.1365-2249.2010.04229.x. PMC 3026543. PMID 20942809.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Inoue, N.; Watanabe, M.; Nanba, T.; Wada, M.; Akamizu, T.; Iwatani, Y. (Maj 2009). »Involvement of functional polymorphisms in the TNFA gene in the pathogenesis of autoimmune thyroid diseases and production of anti-thyrotropin receptor antibody«. Clinical & Experimental Immunology. 156 (2): 199–204. doi:10.1111/j.1365-2249.2009.03884.x. PMC 2759465. PMID 19250279.
- ↑ Saranac, L.; Zivanovic, S.; Bjelakovic, B.; Stamenkovic, H.; Novak, M.; Kamenov, B. (2011). »Why Is the Thyroid So Prone to Autoimmune Disease«. Hormone Research in Paediatrics. 75 (3): 157–165. doi:10.1159/000324442. PMID 21346360.
- ↑ Rose, Noel R.; Bonita, Raphael; Burek, C.Lynne (Februar 2002). »Iodine: an environmental trigger of thyroiditis«. Autoimmunity Reviews. 1 (1–2): 97–103. CiteSeerX 10.1.1.326.5700. doi:10.1016/s1568-9972(01)00016-7. PMID 12849065.
- ↑ Burek, C. Lynne; Talor, Monica V. (november 2009). »Environmental triggers of autoimmune thyroiditis«. Journal of Autoimmunity. 33 (3–4): 183–189. doi:10.1016/j.jaut.2009.09.001. PMC 2790188. PMID 19818584.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Fountoulakis, S; Philippou, G; Tsatsoulis, A (Januar 2007). »The role of iodine in the evolution of thyroid disease in Greece: from endemic goiter to thyroid autoimmunity«. Hormones. 6 (1): 25–35. PMID 17324915.
- ↑ Yu, Xiujie; Li, Lanying; Li, Qingxin; Zang, Xiaoyi; Liu, Zebing (november 2011). »TRAIL and DR5 Promote Thyroid Follicular Cell Apoptosis in Iodine Excess-Induced Experimental Autoimmune Thyroiditis in NOD Mice«. Biological Trace Element Research. 143 (2): 1064–1076. doi:10.1007/s12011-010-8941-5. PMID 21225479.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Pedersen, Inge Bülow; Knudsen, Nils; Jørgensen, Torben; Perrild, Hans; Ovesen, Lars; Laurberg, Peter (Januar 2003). »Thyroid peroxidase and thyroglobulin autoantibodies in a large survey of populations with mild and moderate iodine deficiency: Thyroid autoantibodies and iodine deficiency«. Clinical Endocrinology. 58 (1): 36–42. doi:10.1046/j.1365-2265.2003.01633.x. PMID 12519410.
- ↑ Hansen, Pia S; Brix, Thomas H; Iachine, Ivan; Kyvik, Kirsten O; Hegedüs, Laszlo (Januar 2006). »The relative importance of genetic and environmental effects for the early stages of thyroid autoimmunity: a study of healthy Danish twins«. European Journal of Endocrinology. 154 (1): 29–38. doi:10.1530/eje.1.02060. PMID 16381988.
- ↑ McCombe, P. A.; Mackay, J. M. Greer and I. R.; Mackay, IR (30. november 2009). »Sexual Dimorphism in Autoimmune Disease«. Current Molecular Medicine. 9 (9): 1058–1079. doi:10.2174/156652409789839116. PMID 19747114.
- ↑ Invernizzi, Pietro; Miozzo, Monica; Selmi, Carlo; Persani, Luca; Battezzati, Pier Maria; Zuin, Massimo; Lucchi, Simona; Meroni, Pier Luigi; Marasini, Bianca; Zeni, Silvana; Watnik, Mitchell (1. julij 2005). »X Chromosome Monosomy: A Common Mechanism for Autoimmune Diseases«. The Journal of Immunology. 175 (1): 575–578. doi:10.4049/jimmunol.175.1.575. PMID 15972694.
- ↑ Radetti, Giorgio (2014). »Clinical Aspects of Hashimoto's Thyroiditis«. Paediatric Thyroidology. Endocrine Development. Zv. 26. str. 158–170. doi:10.1159/000363162. ISBN 978-3-318-02720-4. PMID 25231451.
- ↑ 40,0 40,1 40,2 40,3 Maitra, Anirban (2014). »The Endocrine System«. V Kumar, Vinay (ur.). Robbins and Cotran Pathologic Basis of Disease. Elsevier Health Sciences. str. 1073–1140. ISBN 978-0-323-29635-9.
- ↑ Grani, Giorgio; Carbotta, Giovanni; Nesca, Angela; D’Alessandri, Mimma; Vitale, Martina; Del Sordo, Marianna; Fumarola, Angela (Junij 2015). »A comprehensive score to diagnose Hashimoto's thyroiditis: a proposal«. Endocrine. 49 (2): 361–365. doi:10.1007/s12020-014-0441-5. PMID 25280964.
- ↑ Giannini, AJ (1986). The Biological Foundations of Clinical Psychiatry. New Hyde Park, NY: Medical Examination Publishing Company. str. 193–198. ISBN 978-0-87488-449-4.
- ↑ Hashimoto Thyroiditis~workup na eMedicine
- ↑ Weiner, M. J.; Kennedy, C. (Marec 1988). »Prasad's Syndrome«. British Journal of Psychiatry. 152 (3): 438–439. doi:10.1192/bjp.152.3.438b. PMID 3167392.
- ↑ »Does Your Doctor Know About the New TSH Lab Standards?«. Arhivirano iz prvotnega spletišča dne 4. decembra 2010.
- ↑ 46,0 46,1 46,2 Fabrizio Monaco (2012). Thyroid Diseases. Taylor and Francis. str. 78. ISBN 978-1-4398-6839-3.
- ↑ Boyles, Salynn (23. maj 2013). »Hypothyroidism Hikes Death Risk in Blacks«. MedPage Today.
- ↑ McLeod, Donald S. A.; Caturegli, Patrizio; Cooper, David S.; Matos, Peter G.; Hutfless, Susan (16. april 2014). »Variation in Rates of Autoimmune Thyroid Disease by Race/Ethnicity in US Military Personnel«. JAMA. 311 (15): 1563–1565. doi:10.1001/jama.2013.285606. PMID 24737370. Laični povzetek.
{{navedi časopis}}: Sklic uporablja opuščeni parameter|lay-url=(pomoč) - ↑ Natri, Heini; Garcia, Angela R.; Buetow, Kenneth H.; Trumble, Benjamin C.; Wilson, Melissa A. (Julij 2019). »The Pregnancy Pickle: Evolved Immune Compensation Due to Pregnancy Underlies Sex Differences in Human Diseases«. Trends in Genetics. 35 (7): 478–488. doi:10.1016/j.tig.2019.04.008. PMC 6611699. PMID 31200807.
- ↑ Hakaru Hashimoto v slovarju Who Named It?
- ↑ Hashimoto, Hakaru (1912). »Zur Kenntnis der lymphomatösen Veränderung der Schilddrüse (Struma lymphomatosa)« [Knowledge of lymphomatous changes in the thyroid gland (goiter lymphomatosa)]. Archiv für Klinische Chirurgie (v nemščini). 97: 219–248. NAID 10005555208.
- ↑ Lepoutre, Thibault; Debiève, Frederic; Gruson, Damien; Daumerie, Chantal (1. januar 2012). »Reduction of Miscarriages through Universal Screening and Treatment of Thyroid Autoimmune Diseases«. Gynecologic and Obstetric Investigation. 74 (4): 265–273. doi:10.1159/000343759. PMID 23147711.
- ↑ Gaberšček, Simona; Zaletel, Katja (september 2011). »Thyroid physiology and autoimmunity in pregnancy and after delivery«. Expert Review of Clinical Immunology. 7 (5): 697–707. doi:10.1586/eci.11.42. PMID 21895480.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Budenhofer, Brigitte K.; Ditsch, Nina; Jeschke, Udo; Gärtner, Roland; Toth, Bettina (Januar 2013). »Thyroid (dys-)function in normal and disturbed pregnancy«. Archives of Gynecology and Obstetrics. 287 (1): 1–7. doi:10.1007/s00404-012-2592-z. PMID 23104052.
- ↑ Balucan, Francis S.; Morshed, Syed A.; Davies, Terry F. (2013). »Thyroid Autoantibodies in Pregnancy: Their Role, Regulation and Clinical Relevance«. Journal of Thyroid Research. 2013: 182472. doi:10.1155/2013/182472. PMC 3652173. PMID 23691429.
- ↑ »Endocrine Experts Support Screening for Thyroid Dysfunction in Pregnant Women«. Endocrine Society. Endocrine Society. 26. marec 2015. Arhivirano iz prvotnega spletišča dne 8. oktobra 2015. Pridobljeno 4. oktobra 2015.
- ↑ Carlé, Allan; Pedersen, Inge Bülow; Knudsen, Nils; Perrild, Hans; Ovesen, Lars; Rasmussen, Lone Banke; Laurberg, Peter (1. junij 2014). »Development of Autoimmune Overt Hypothyroidism Is Highly Associated With Live Births and Induced Abortions but Only in Premenopausal Women«. The Journal of Clinical Endocrinology & Metabolism. 99 (6): 2241–2249. doi:10.1210/jc.2013-4474. PMID 24694338.
- ↑ Weetman, Anthony P. (Junij 2010). »Immunity, thyroid function and pregnancy: molecular mechanisms«. Nature Reviews Endocrinology. 6 (6): 311–318. doi:10.1038/nrendo.2010.46. PMID 20421883.
- ↑ Lazarus, John H. (1. marec 2011). »The Continuing Saga of Postpartum Thyroiditis«. The Journal of Clinical Endocrinology & Metabolism. 96 (3): 614–616. doi:10.1210/jc.2011-0091. PMID 21378224.
- ↑ Kokandi, A. A.; Parkes, A. B.; Premawardhana, L. D. K. E.; John, R.; Lazarus, J. H. (Marec 2003). »Association of Postpartum Thyroid Dysfunction with Antepartum Hormonal and Immunological Changes«. The Journal of Clinical Endocrinology & Metabolism. 88 (3): 1126–1132. doi:10.1210/jc.2002-021219. PMID 12629095.
- ↑ Koopmans, Marije; Kremer Hovinga, Idske C.L.; Baelde, Hans J.; Harvey, Mark S.; de Heer, Emile; Bruijn, Jan A.; Bajema, Ingeborg M. (Junij 2008). »Chimerism occurs in thyroid, lung, skin and lymph nodes of women with sons«. Journal of Reproductive Immunology. 78 (1): 68–75. doi:10.1016/j.jri.2008.01.002. PMID 18329105.
