Vodikov fluorid
| |||
| Identifikatorji | |||
|---|---|---|---|
3D model (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.759 | ||
| KEGG | |||
PubChem CID
|
|||
| RTECS število |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| FH | |||
| Molska masa | 20,01 g·mol−1 | ||
| Videz | brezbarven plin, pri temperaturi pod 19,5°C brezbarvna tekočina | ||
| Gostota | 1,15 g/L (plin, 25 °C), 0,99 g/mL (tekočina, 19,5 °C) | ||
| Tališče | −83,6 °C (−118,5 °F; 189,6 K) | ||
| Vrelišče | 19,5 °C (67,1 °F; 292,6 K) | ||
| z vodo se meša v vseh razmerjih | |||
| Kislost (pKa) | 3,17[1][2] | ||
| Lomni količnik (nD) | 1,00001 | ||
| Struktura | |||
| Oblika molekule | linearna | ||
| Dipolni moment | 1,86 D | ||
| Termokemija | |||
| Standardna molarna entropija S |
8,687 J/g K (plin) | ||
Std tvorbena
entalpija (ΔfH⦵298) |
−13,66 kJ/g (plin) −14,99 kJ/g (tekočina) | ||
| Nevarnosti | |||
EU klasifikacija (DSD) (zastarelo)
|
|||
| NFPA 704 (diamant ognja) | |||
| Sorodne snovi | |||
| Drugi anioni | vodikov klorid vodikov bromid vodikov jodid | ||
| Drugi kationi | natrijev fluorid | ||
| Sorodne snovi | voda amonijak | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Vodikov fluorid je spojina vodika in fluora s kemijsko formulo HF. Je brezbarven plin ali tekočina in osnovna surovina za industrijsko proizvodnjo fluora in s tem predhodnik številnih spojin, vključno s farmacevtskimi proizvodi in polimeri, npr. teflonom. Njegova vodna raztopina je fluorovodikova kislina. HF se pogosto uporablja tudi v petrokemični industriji in je sestavina številnih superkislin. Njegovo vrelišče (19,5 °C) je blizu sobne temperature, medtem ko so drugi vodikovi halogenidi mnogo bolj hlapni in vrejo pri precej nižjih temperaturah. Za razliko od drugih vodikovih halogenidov je HF lažji od zraka in razmeroma hitro difundira skozi porozne snovi.
Vodikov fluorid je izredno nevaren plin, ki v stiku s tkivi tvori jedko in prodorno fluorovodikovo kislino. V plinastem stanju lahko zaradi hitrega uničenja roženice povzroči slepoto.
Odkritje vodikovega fluorida se pripisuje francoskemu kemiku Edmondu Frémyju (1814-1894), ki je poskušal izolirati fluor, čeprav je velike količine fluorovodikove kisline pripravil že Carl Wilhelm Scheele leta 1771. Fluorovodikova kislina je bila v steklarski industriji znana že pred Frémyjevim odkritjem.
Zgradba[uredi | uredi kodo]

Pri temperaturah okrog sobne temperature in nad njo je brezbarven plin. V trdnem stanju (zmrzne pri −83.6 °C) tvori ortorombske kristale, zgrajene iz cikcakastih verig molekul HF. Razdalja med H in F v molekuli HF je 95 pm, razdalja med sosednjima molekulama pa 155 pm.[3] Iz verig HF je sestavljen tudi tekoči HF, le da so verige krajše in v povprečju dolge pet do šest molekul.[4]
Vodikove vezi[uredi | uredi kodo]
Molekule HF so med seboj povezane z vodikovimi vezmi, zato je njegovo obnašanje bolj podobno obnašanju vode kot drugih vodikovih halogenidov, na primer HCl.[5][6][7] Vodikove vezi povečajo njegovo viskoznost v tekoči fazi in znižajo pričakovani parni tlak v plinski fazi. Vodikov fluorid vre pri skoraj 20 °C, kar je mnogo višje kot drugi vodikovi halogenidi, ki vrejo med -85 in -35 °C.
Vodikov fluorid se meša z vodo v vseh razmerjih, medtem ko je topnost drugih vodikovih halogenidov v vodi omejena. Z vodo tvori tudi več trdnih spojin, od katerih je najvidnejša spojina H2O·HF, ki zmrzne šele pri -40 °C, kar je 44 °C nad zmrziščem čistega HF.[8]
| Podobnosti med HF in H2O | |

|

|
| Vrelišča vodikovih halogenidov (modro) in halkogenidov (rdeče): HF in H2O se ne vkljapljata v njihove trende | Tališča zmesi HF/H2O; puščice označujejo trdne spojine |
Kislost[uredi | uredi kodo]
Razredčena fluorovodikova kislina je v primerjavi s klorovodikovo kislino šibka kislina,[9] kar je delno posledica močne vezi H-F, delno pa posledica na primer tvorbe grozdov HF, H2O in anionov F-.[10] Pri visokih koncentracijah se pojavi homoasociacija molekul HF, s katero nastanejo večatomski ioni, na primer HF−
2, ki močno povečajo njeno kislost.[11] Homoasociacija v koncentriranih raztopinah povzroči pri mešanju z močnimi kislinami, na primer s klorovodikovo in žveplovo kislino, protoniranje slednjih.[12] Fluorovodikova kislina je kljub temu, da se prišteva med šibke kisline, zelo jedka.[11]
Kislost fluorovodikove kisline je zaradi vodikovih vezi zelo odvisna od njene koncentracije. Razredčene raztopine so šibko kisle s konstanto kisline Ka = 6.6×10−4 (ali pKa = 3,18). Kisline drugih vodikovih halogenidov so močne s Ka < 0. Meritve Hammetove funkcije kislosti H0 (dejanskega pH) kažejo, da so koncentrirane raztopine HF mnogo močnejše kot bi pričakovali.[13] H0 100 % HF je ocenjana na −10,2 do −11. Žveplova kislina ima, za primerjavo, vrednost -12.[14][15]
S termodinamskega stališča so raztopine HF zelo neidealne z aktivnostjo HF, ki narašča mnogo hitreje kot koncentracija. Šibko kislost v razredčenih raztopinah se včasih pripisuje visoki jakosti vezi H-F, ki skupaj z visoko topilno entalpijo HF prevlada bolj negativno hidratacijsko entalpijo fluoridnega iona.[16] Giguère in Turrell[17][18] sta po drugi strani z infrardečo spektroskopijo dokazala, da med topljenci prevladuje z vodikovo vezjo povezan ionski par [H3O+•F−], kar kaže, da se ionizacijo lahko opiše s parom zaporednih ravnotežij:
- H2O + HF ⇌ [H3O+•F−]
- [H3O+•F−] ⇌ H3O+ + F−
Prvo ravnotežje je pomaknjeno precej v desno (K >> 1), drugo pa v levo (K << 1), kar pomeni, da je HF močno dosociirana, vendar močno povezani ionski pari zmanjšajo termodinamsko aktivnost H3O+ ionov, tako da je raztopina dejansko manj kisla.[19]
V koncentriranih raztopinah dodatni HF povzroči disociacijo ionskih parov in tvorbo z vodikovo vezjo povezanega hidrogendifluoridnega iona.:[17][19]
- [H3O+•F−] + HF ⇌ H3O+ + HF−
2.
Naraščanje vsebnosti prostih H3O+ ionov povzroči hitro povečanje kislosti, fluoridni ioni pa se zaradi močnih vodikovih vezi, ki HF pretvorijo v HF−
2, stabilizirajo, se pravi da postanejo manj bazični. Vzajemno delovanje kisline in njene lastne konjugirane baze se imenuje homoasociacija ali homokonjugacija. V 100 % fluorovodikovi kislini pride do samoionizacije[20][21]
- 3 HF ⇌ H2F+ + HF−
2,
zaradi katere postane raztopina ekstremno kisla (H0 = −11).
Kislost brezvodnega HF se lahko še poveča z dodajanjem Lewisovih kislin, na primer SbF5, ki zniža H0 na -21.[14][15]
Topilo[uredi | uredi kodo]
Suh vodikov fluorid dobro topi nizko valentne kovinske fluoride in več molekularne fluoride. V njem se reverzibilno topijo tudi številni proteini in ogljikovi hidrati. Večina anorganskih nefluoridnih spojin se v njem ne topi ampak z njim reagira.[22]
Proizvodnja in uporaba[uredi | uredi kodo]
Vodikov fluorid se proizvaja z delovanjem žveplove kisline na rude, bogate z mineralom fluoritom. Nastaja tudi kot stranski produkt pri proizvodnji fosforjeve kisline iz različnih mineralov.
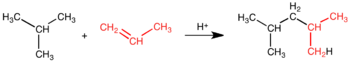
Brezvodna spojina se uporablja bolj pogosto kot njegova vodna raztopina fluorovodikova kislina. Uporablja se kot katalizator v procesih alkiliranja v rafinerijah nafte. Z alkiliranjem se iz alkenov s tremi in štirimi C atomi in izobutana (2-metilpropan) proizvaja tako imenovani alkilat, ki je sestavina visokooktanskega bencina.[23]
HF je reaktivno topilo pri elektrokemijskem fluoriranju organskih spojin. V teh procesih se HF oksidira v prisotnosti ogljikovodika, potem pa fluor zamenja vodik v vezi C-H, tako da nastane vez C-F. Na ta način se proizvajajo perfluorirane karboksilne kisline in sulfonske kisline.[23]
Kot katalizator se uporablja tudi v večini naprav za proizvodnjo linearnih alkilbenzenov. Proces se začne z dehidrogeniranjem n-alkanov v alkene, ki nato reagirajo z benzenom s HF kot katalizatorjem.
Elementarni fluor (F2) se proizvaja z elektrolizo raztopine HF in kalijevega bifluorida (K+[F-H-F]-). Kalijev bifluorid je potreben zato, ker brezvodni vodikov fluorid ne prevaja električnega toka. Na ta način se proizvede nekaj tisoč ton fluora letno.[24]
Alkil kloridi (ROCl) in kislinski anhidridi (R1-CO-O-CO-R2) reagirajo z vodikovim fluoridom v alkil fluoride (RCOF).[25]
HF se pogosto uporablja v palinologiji za odstranjevanje silikatnih mineralov, za ekstrakcijo cist dinoflagelatov, akritarhov in hitinozoj.
1,1-difluoroetan se proizvaja z adicijo vodikovega fluorida na acetilen z živim srebrom kot katalizatorjem:[26]
- HC≡CH + 2 HF → CH3CHF2
Vmesni produkt je vinil fluorid, monomer za sintezo polivinil fluorida.
Vpliv na zdravje[uredi | uredi kodo]

HF se v stiku z vlago, tudi tisto v tkivih, takoj pretvori v fluorovodikovo kislino, ki je izredno jedka in strupena in zahteva takojšnjo zdravniško pomoč.[27]
Vdihavanje večjih količin vodikovega fluorida ali kombinacija manjših količin in stika s kožo lahko povzroči smrt zaradi srčne aritmije ali pljučnega edema.[27]
Sklici[uredi | uredi kodo]
- ↑ »pKa's of Inorganic and Oxo-Acids« (PDF). Harvard. Arhivirano iz prvotnega spletišča (PDF) dne 2. oktobra 2013. Pridobljeno 9. septembra 2013.
- ↑ Bruckenstein, S.; Kolthoff, I.M., in Kolthoff, I.M.; Elving, P.J. Treatise on Analytical Chemistry, Vol. 1, pt. 1; Wiley, NY, 1959, str. 432-433.
- ↑ M. W. Johnson, E. Sándor, E. Arzi (1975). The Crystal Structure of Deuterium Fluoride. Acta Crystallographica B31 (8): 1998–2003. doi: 10.1107/S0567740875006711.
- ↑ S.E. Mclain, C.J. Benmore, J.E. Siewenie, J. Urquidi, J.F. Turner (2004). On the Structure of Liquid Hydrogen Fluoride. Angewandte Chemie, International Edition 43 (15): 1952–55. doi: 10.1002/anie.200353289. PMID 15065271.
- ↑ L.A. Pauling (1960). The nature of the chemical bond and the structure of molecules and crystals: An introduction to modern structural chemistry. Cornell University Press. str. 454–464. ISBN 978-0-8014-0333-0.
- ↑ P. Atkins, L. Jones (2008). Chemical principles: The quest for insight. W. H. Freeman & Co. str. 184–185. ISBN 978-1-4292-0965-6.
- ↑ J. Emsley (1981). The hidden strength of hydrogen. New Scientist 91 (1264): 291–292. Pridobljeno 25. decembra 2012.
- ↑ N.N. Greenwood, A. Earnshaw (1998). Chemistry of Elements[mrtva povezava]. 2. izdaja.
- ↑ E. Wiberg, N. Wiberg (urednik), A. F. Holleman (urednik) (2001). Inorganic Chemistry. 1. izdaja. str. 425. ISBN 978-0123526519.
- ↑ J. Clark (2002). The acidity of the hydrogen halides. Pridobljeno 4. septembra 2011.
- ↑ 11,0 11,1 C. Chambers, A.K. Holliday (1975). Modern inorganic chemistry (An intermediate text) Arhivirano 2015-12-27 na Wayback Machine.. The Butterworth Group. str. 328–329.
- ↑ H.J. Hannan (2010). Course in chemistry for IIT-JEE 2011. Tata McGraw Hill Education Private Limited. str. 15–22. ISBN 9780070703360.
- ↑ H.H. Hyman in drugi (1957). The Hammett acidity function H0 for HF aqueous solutions. J. Amer. Chem. Soc. 79 (14): 3668. doi: 10.1021/ja01571a016.
- ↑ 14,0 14,1 W.L. Jolly (1984). Modern Inorganic Chemistry. McGraw-Hill. str. 203. ISBN 0-07-032768-8.
- ↑ 15,0 15,1 F.A. Cotton, G. Wilkinson (1988). Advanced Inorganic Chemistry, 5. izdaja. John Wiley and Sons: New York. str. 109. ISBN 0-471-84997-9.
- ↑ C.E. Housecroft, A.G. Sharpe (2005). Inorganic Chemistry. 2. izdaja. Pearson Prentice Hall. str. 170.
- ↑ 17,0 17,1 P.A. Giguère, S. Turrell (1980). The nature of hydrofluoric acid. A spectroscopic study of the proton-transfer complex H3O+...F−. J. Am. Chem. Soc. 102 (17): 5473. doi: 10.1021/ja00537a008.
- ↑ R. Iftimie, T. Vibin, S. Plessis, P. Marchand, P. Ayotte (2008). Spectral Signatures and Molecular Origin of Acid Dissociation Intermediates. J. Am. Chem. Soc. 130 (18): 5901–7. doi: 10.1021/ja077846o. PMID 18386892.
- ↑ 19,0 19,1 Cotton in Wilkinson (1988), str. 104.
- ↑ C.E. Housecroft, A.G. Sharpe. Inorganic Chemistry. Str. 221.
- ↑ Cotton in Wilkinson (1988), str. 111.
- ↑ Greenwood in Earnshaw (1998), str. 816–819.
- ↑ 23,0 23,1 J. Aigueperse, P. Mollard, D. Devilliers, M. Chemla, R. Faron, R. Romano, J. P. Cuer (2005). Fluorine Compounds, Inorganic. Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.a11_307.
- ↑ M. Jaccaud, R. Faron, D. Devilliers, R. Romano (2005). Fluorine. Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi: 10.1002/14356007.a11_293.
- ↑ G. Olah, S. Kuhn (1961). Preparation of Acyl Fluorides with Anhydrous Hydrogen Fluoride. The General Use of the Method of Colson and Fredenhagen. J. Org. Chem 26: 237–238. doi: 10.1021/jo01060a600.
- ↑ S. Günter, W. Schwertfeger, A. Feiring, B. Smart, F. Behr, H. Vogel, B. McKusick (2010). Fluorine Compounds, Organic. Ullmann's Encyclopedia of Industrial Chemistry. John Wiley & Sons. doi: 10.1002/14356007.a11_349.
- ↑ 27,0 27,1 http://emergency.cdc.gov/agent/hydrofluoricacid/basics/facts.asp Facts About Hydrogen Fluoride (Hydrofluoric Acid). Pridobljeno 3. decembra 2014.
Zunanje povezave[uredi | uredi kodo]
 Predstavnosti o temi vodikov fluorid v Wikimedijini zbirki
Predstavnosti o temi vodikov fluorid v Wikimedijini zbirki



