Osmoza
Osmóza (tudi ozmoza, iz grš.: ὄσμος pritisk, tlak) je usmerjen prehod topila skozi polprepustno sredstvo. Pojav je poseben primer difuzije, širše pa je vrsta pasivnega transporta. Topilo prehaja iz področja z nižjo koncentracijo raztopljene snovi v področje z višjo koncentracijo. Polprepustno sredstvo je prehodno za topilo, ne pa za raztopljeno snov (topljenec). Polprevodni medij je pogosto opna (membrana) ali delilna pregrada oziroma diafragma. Pojav je zelo pomemben za življenje.
Potek osmoze[uredi | uredi kodo]
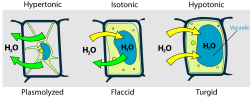
Delci topila prehajajo iz raztopine z manjšo koncentracijo topljenca v raztopino z višjo koncentracijo, na koncu pa se koncentraciji izenačita kot tudi osmotska tlaka raztopin. Povezavo med osmotskim tlakom in koncetracijo topila podaja Van 't Hoffov zakon. Ker so skozi polprepustno opno (polprevodno membrano) prehajali delci topila, se na eni strani prostornina zmanjša, na drugi strani pa enako poveča.
Kot pri izravnavi temperature tudi pri osmozi za proces ni potrebno dovesti energije.
Pri osmozi gre v bistvu za izravnavo kemijskega potenciala obeh raztopin. Ker prehaja skozi membrano le topilo, obravnavamo kemijski potencial topila, koncentracija topljenec le spreminja kem. potencial topila. Vedno moramo imeti v mislih, da narava teži k ravnotežju, torej raztopini bosta v ravnotežju le, ko bosta njuna kem. potenciala enaka. Raztopina višje koncentracije ima nižji kem. potencial kot raztopina nižje koncentracije. Da bosta raztopini spet v ravnotežju, se mora raztopini večje koncentracije kem. potencial povečati. Topilo prehaja iz višjega potenciala do nižjega, kar zasledimo pri spontanih procesih.
Kemijski potencial se povečuje tudi, če se poveča hidrostatični tlak (ne osmotski), in obratno. Napačno je mišljenje, da ima raztopina večje koncentracije večji tlak, ker potem, bi se moral ta zmanjšati, da bi prišlo do ravnotežja. V bistvu mora šele priti do povečanja tlaka, da bo sistem spet v ravnotežju. Raztopina večje (manjše) koncentracije ima torej tendenco do razredčevanja (koncentriranja) ali/in povečanja (zmanjšanja) tlaka.
Van 't Hoffov zakon[uredi | uredi kodo]
Za razredčeno raztopino velja van 't Hoffov zakon:
kjer je p osmotski tlak, V prostornina raztopine, m masa topljenca, M njegova kilomolska masa, R splošna plinska konstanta in T temperatura. Zakon se imenuje po nizozemskem kemiku Jacobusu Henricusu van 't Hoffu. Enačba je sorodna plinski enačbi za idealni plin.
Osmotski tlak[uredi | uredi kodo]
Osmotski tlak neke vrste delcev je približno enak tlaku idealnega plina z gostoto teh delcev.
Zgledi[uredi | uredi kodo]

Pri kuhanju zelenjavne juhe uporabimo sol, da preprečimo vstopanje vode v rahlo slano zelenjavo, ki bi s tem nabreknila, celične stene bi popokale, vsebina celic bi iztekla v okolico, jed pa izgubila okus. Obratno dosežemo pri kuhanju mesne juhe z opustitvijo soljenja vode – zaradi osmotskega vdiranja vode meso se izločijo snovi, ki dajo juhi okus. (Opomba avtorja: Pred koncem kuhanja pa juho le solite, sicer je neokusna).
Dializa je mogoča samo zaradi osmoze. Pri tem se nahaja na eni strani membrane močno nasičen dializant, na drugi pa kri. Kri se pri tem očisti.
Drevesa in druge rastline prenašajo vodo od korenin proti vrhu. Po raziskavah skupine na Univerzi Severne Karoline lahko zrastejo drevesa največ do višine 130 m. Višje osmotični pritisk ne zadošča več za premagovanje težnosti. (Vir: Nature Vol 428, april 2004).
Pokanje zrelih češenj po dežju je posledica osmotičnega vdora vode v češnje.
Solne elektrarne bi pridobivala električno energijo na osnovi osmoze med sladko (rečno) in slano (morsko) vodo. Osmotski tlak med rečno in morsko vodo je okoli 260 m vodnega stolpca.
Literatura[uredi | uredi kodo]
- Franc Lazarini, Jurij Brenčič, Splošna in anorganska kemija, Državna založba Slovenije, Ljubljana 1984, str. 179-180.

