Karvon

| |||
| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
2-metil-5-(1-metiletenil)-cikloheksen-1-on
| |||
| Druga imena
5-izopropenil-2-metil-2-cikloheksen-1-on
| |||
| Identifikatorji | |||
| |||
| ChemSpider | |||
| ECHA InfoCard | 100.002.508 | ||
CompTox Dashboard (EPA)
|
|||
| Lastnosti | |||
| C10H14O | |||
| Molska masa | 150,22 g·mol−1 | ||
| Videz | Brezbarvna oljnata tekočina | ||
| Tališče | 252 °C (486 °F; 525 K) | ||
| Vrelišče | 231 °C (448 °F; 504 K) | ||
| Netopno v mrzli vodi, delno topno v vroči vodi. | |||
| Nevarnosti | |||
| Glavne nevarnosti | vnetljiv | ||
| R-stavki (zastarelo) | R22 | ||
| S-stavki (zastarelo) | S36 | ||
| NFPA 704 (diamant ognja) | |||
| Sorodne snovi | |||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Karvon spada med terpene in je monoterpenski keton.[1] Najdemo ga lahko v eteričnih oljih kumine in navadnega kopra.[2]
Optična izomerija in vonj[uredi | uredi kodo]
Karvon je spojina, ki ima dva enantiomera: (R-)-karvon, ki diši po meti ter (S+)-karvon, ki ima vonj kumine. Vonja lahko ločimo, ker imajo vohalni receptorji kiralno skupino, ki nam omogoča ločevanje omenjenih spojin.[3] Med enantiomeroma prav tako ločijo nekatere vrste opic.[4]
Nahajališča[uredi | uredi kodo]
(S+)-karvon je glavna sestavina olja iz semen kumine (50-70 %).[5] V olju, ki ga pridobivajo iz semen navadnega kopra, se nahaja približno 40-60 % (S+)-karvona. (R-)–karvon je prisoten v olju mete (51 % in več).[6] Meta predstavlja glavni vir (R-)–karvona v naravi, industrijsko pa ga pridobivajo s pretvorbo limonena.[7]
Zgodovina[uredi | uredi kodo]
Stari Rimljani so kumino uporabljali za zdravljenje,[2] vendar takrat še niso poznali izoliranega karvona v čisti obliki. Izolacijo je prvič opravil Franz Varrentrapp leta 1841.[8] Prvotno je bil imenovan karvol , vendar sta ga Goldschmidt in Zurrer opredelila med ketone, dokler ni leta 1894 njegove strukture razjasnil Georg Wagner.[9]
Priprava in uporaba[uredi | uredi kodo]
(S+)-karvon pridobimo s frakcionirno destilacijo olja kumine. (R-)-karvon pridobivajo tako, da olju najprej dodajo vodikov sulfid, nato dodajo še natrijev hidroksid v etanolu. Sledi destilacija z vodno paro.
Karvon proizvajajo sintetično, pri čemer kot izhodno spojino uporabljajo limonen nitrozoklorid. Biosinteza karvona poteka z oksidacijo limonena.
Oba enantiomera karvona se uporabljata v prehrambeni industriji za dodajanje okusa. V kmetijstvu uporabljajo predvsem (S+)-karvon, saj preprečuje kaljenje pri krompirju med shranjevanjem.[2] (R-)-karvon je uporaben kot insekticid proti komarjem ter kot pesticid.[10] Prav tako ga, zaradi vonja po meti, pogosto uporabljajo v osvežilcih zraka ter pri aromaterapiji.
Kemijske lastnosti[uredi | uredi kodo]
Redukcija[uredi | uredi kodo]
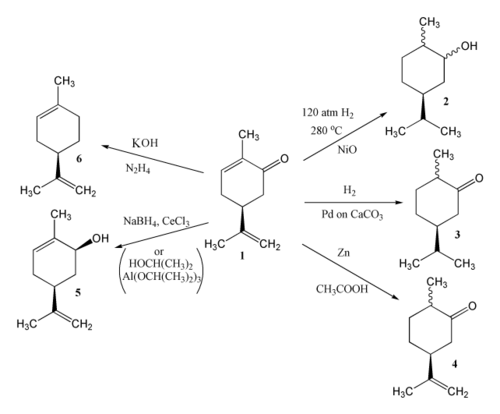
V karvonu je možna redukcija treh dvojnih vezi, pri čemer je produkt odvisen od reagentov in pogojev pri reakciji. Pri katalitičnem hidrogeniranju karvona (1) lahko nastane karvomentol (2) ali karvomenton (3). Z uporabo cinka in ocetne kisline se karvon reducira do dihidrokarvona (4). Z uporabo propan-2-ola in aluminijevega izopropoksida se reducira zgolj ketonska skupina, pri čemer nastane karvol (5). Enak produkt nastane po uporabi CeCl3 in NaBH4. Pri reakciji karvona, hidrazina in kalijevega hidroksida nastane limonen (6).
Oksidacija[uredi | uredi kodo]
Pri oksidaciji dobimo različne produkte. Če barijev hidroksid reagira s karvonom v prisotnosti zraka, nastane diketon (7). Vodikov peroksid oksidira karvon do epoksida (8). Pri reakciji z ozonom ter z vodno paro nastane dilakton (9). Reakcija s kalijevim permanganatom da sledeč produkt (10).
Konjugirani dodatki[uredi | uredi kodo]
Karvon kot α,β-nenasičen keton lahko reagira po mehanizmu nukleofilne konjugacijske adicije. (CH3)2CuLi reagira s karvonom v prisotnosti etra. Metilna skupina se doda na trans mesto izopropilne skupine. Produkt je enolat, ki se lahko pretvori v keton ob reakciji z alil bromidom.[11]
Presnova[uredi | uredi kodo]
Študije in vivo so pokazale, da se oba enantiomera pretvorita v dihidrokarvonsko ter karvonsko kislino.[12] (S+)-karvon se pretvori v (s+)-karveol, (R-)-karveol pa se tvori po redukciji (R-)-karvona z NADPH.[13] Proces se dogaja v jetrih in vključuje citokrom P450 oksidazo in trans-karveol dehidrogenazo.
Sklici in opombe[uredi | uredi kodo]
- ↑ Simonsen, J. L. (1953). The Terpenes. Zv. 1 (2. izd.). Cambridge: Cambridge University Press. str. 394–408.
- ↑ 2,0 2,1 2,2 De Carvalho, C. C. C. R; Da Fonseca, M. M. R. "Carvone: Why and how should one bother to produce this terpene" Food Chemistry 2006, 95, 413-422.
- ↑ Theodore J. Leitereg; Dante G. Guadagni; Jean Harris; Thomas R. Mon; Roy Teranishi (1971). »Chemical and sensory data supporting the difference between the odors of the enantiomeric carvones«. J. Agric. Food Chem. 19 (4): 785. doi:10.1021/jf60176a035.
- ↑ Laska, M.; Liesen, A.; Teubner, P. American Journal of Physiology- Regulatory Integrative and Comparative Physiology, 1999, 277, R1098-R1103.
- ↑ Hornok, L. Cultivation and Processing of Medicinal Plants, John Wiley & Sons, Chichester, UK, 1992.
- ↑ Chemical composition of essential oil from several species of mint (Mentha spp.), [1]
- ↑ Fahlbusch, Karl-Georg; Hammerschmidt, Franz-Josef; Panten, Johannes; Pickenhagen, Wilhelm; Schatkowski, Dietmar; Bauer, Kurt; Garbe, Dorothea; Surburg, Horst (2003). »Flavors and Fragrances«. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a11_141. ISBN 978-3-527-30673-2.
- ↑ Handwörterbuch der reinen und angewandten Chemie [Concise dictionary of pure and applied chemistry] (Braunschweig, (Germany): Friedrich Vieweg und Sohn, 1849), letnik 4, str. 686-688. [2]
- ↑ Georg Wagner (1894) "Zur Oxydation cyklischer Verbindungen" (On the oxidation of cyclic compounds), Berichte der Deutschen chemischen Gesellschaft zu Berlin, letnik 27, str. 2270-2276.
- ↑ ENVIRONMENTAL PROTECTION AGENCY. »Pesticide Products; Registration Application«. Federal Register. 74 (41): 9396–9397.[mrtva povezava]
- ↑ Srikrishna, A.; Jagadeeswar Reddy, T. (1998). »Enantiospecific synthesis of (+)-(1S, 2R, 6S)-1, 2-dimethylbicyclo [4.3. 0] nonan-8-one and (-)-7-epibakkenolide-A«. Tetrahedron. 54 (38): 11517–11524. doi:10.1016/S0040-4020(98)00672-3. Pridobljeno 22. januarja 2008.
- ↑ Engel, W. (2001). »In vivo studies on the metabolism of the monoterpenes S-(+)- and R-(-)-carvone in humans using the metabolism of ingestion-correlated amounts (MICA) approach«. J. Agric. Food Chem. 49 (8): 4069–4075. doi:10.1021/jf010157q. PMID 11513712.
- ↑ Jager, W.; Mayer, M.; Platzer, P.; Reznicek, G.; Dietrich, H.; Buchbauer, G. (2000). »Stereoselective metabolism of the monoterpene carvone by rat and human liver microsomes«. Journal of Pharmacy and Pharmacology. 52 (2): 191–197. doi:10.1211/0022357001773841. PMID 10714949.
Zunanje povezave[uredi | uredi kodo]
- [mrtva povezava] Eterično olje karvona (na 3-4 strani)